電離 と 電気 分解 の 違い
花 てまり 南 草津電気分解と電離の違いとは?違いを解説 | 違い辞典. 電離 と 電気 分解 の 違い電気分解は物質を分解するプロセスであり、電離は物質が電気的に帯電する現象です。 両者はそれぞれ重要な役割を果たし、さまざまな応用がされています。 電気分解と電離の違いとは. 電気分解と電離は、化学や物理学の分野で重要な概念ですが、それぞれ異なる現象を指しています。 まず、電気分解は電流を通すことで物質が分解する現象です。 電気分解はボルタ電池や電解槽などを用いて行われます。 この現象は、電解質溶液中にあるイオンが電気的な力によって分解され、それぞれのイオンが電極に移動することで起こります。 具体的には、陽極(正極)では陽イオンが酸化され、陰極(負極)では陰イオンが還元されます。. 「電離」と「電気分解」の違いとは?分かりやすく解釈 | 違い . この記事では、「電離」と「電気分解」の違いを分かりやすく説明していきます。. 「電離」とは?電離とは、でんりという読み方をすべき言葉です。. 電離と電気分解の違いについて - ちょっと前に学校の理科で . ふたつの違い、というと、電離は現象の名前で電気分解は実験操作のこと・・・とでもいえばいいでしょうか。 電離とは、物質がイオンにわかれる(そして水和する)ことをいいます。 塩化水素を水にとかすと塩酸になりますよね。そのときの水中での. 電気分解の基本|電池と電気分解の3つの違いを意識する . 電池と電気分解の3つの違い さて,電気分解の説明が終わったので,本題に移ります.電池と電気分解には,大まかに次の3つの違いがあります. 自動的反応・受動的反応の違い 正極・陽極(負極・陰極)の違い 酸化・還元の違い. 電離 と 電気 分解 の 違い中3理科 化学変化とイオン 電解質・電離式・電気分解. 電気分解と電離の違い 電気分解は電解質水溶液に電流を流して陽イオンを陰極に、陰イオンを陽極に移動させて分解すること、電離は水に溶けて陽イオンと陰イオンに分かれることです。. 電気分解とは(陽極陰極の区別・電極の場合分け・装置・水や . 電池の負極と電気分解の陰極、電池の正極と電気分解の正極、それぞれの違い 電気分解の陰極 ‥ 電子が与えられ 、還元反応が起こる。 電池の負極 ‥ 電子を押し出し 、酸化反応が起こる。. 「電気分解」って何? 分解される仕組みや身近な活用例も見て . 電解質溶液に電気を流すと、イオンはそれぞれ反対の電気を持つ電極に引き付けられ、そこで化学反応を起こすのです。 電気分解の仕組み。 陽極には陰イオンが、陰極には陽イオンが引き付けられる。 電気分解できない物質も. 身の回りには、水に溶けても電解しない物質があります。 そうした物質を「非電解質」といい、砂糖やアルコール、ベンゼンなどが代表的です。 アルコールが電解しない性質は、パソコンやスマートフォンなどの電子基板の洗浄に役立ちます。 多くの電子部品が組み込まれている基板に、電解質を含む洗剤を使用すると、思わぬ場所に電気が流れて故障する可能性があります。 しかし「無水エタノール」のような純度の高いアルコールなら、電気を通さないため安心して使えるのです。 関連記事はこちら. 電気分解の原理とは? わかりやすく解説! | 科学をわかり . | 科学をわかりやすく解説. 電気分解の原理とは? わかりやすく解説! 2020.03.12 2015.03.07. 電解質の水溶液に電流を通すとイオンが電気を運ぶ役目をして電極にくっついて電気を失い、もとの物質と違う物質を生じます。 イオンがあれば、いつもこのような電気分解が行われるかどうかこれから調べることにしましょう。 目次. 電気分解の原理. 水の電気分解. 電気分解の原理. ジサツ の ため の 101 の 方法 中古
歩調 を 合わせる 心理電解質の水溶液には陽イオンと陰イオンとが数多くあります。 この溶液に、2つの電極を浸して片方を電池の陽極につなぎ、もう一方を陰極につなぎます。 すると、陽イオンは陰極のほうへ陰イオンは陽極のほうへ引っぱられて動きます。 つまり、水溶液の中を電流が通るわけですが金属の中を電流が通るときと様子が違います。. 電気分解(原理・反応式・電池との関係など) | 化学のグルメ. 電離 と 電気 分解 の 違いはじめに 【プロ講師解説】このページでは『電気分解(原理・反応式・電池との関係など)』について解説しています。 電気分解とは 炭素C電極を使って塩化銅CuCl2水溶液に電気刺激を与えると、陰極では単体の銅Cuが析出し、陽極では. 電気分解の仕組みと電気分解による様々な物質の化学反応式. 電気分解の仕組みと電気分解による様々な物質の化学反応式. 化学の分野において幾種類かの化学変化を学習します。 その代表例とも言うことができるのが「分解」です。 分解とは、1種類の物質が2種類以上の物質に分かれる化学変化のことを言いました。 中高で学習する化学変化のカテゴリーの数自体はそう多くはありません。 そのため大切なことは、それぞれの化学変化の中で具体例として挙げられる、実際の化学変化、化学反応式を確実に押さえてしまうことです。 抽象論の理解だけでは定着が難しいのが化学範囲です。 実験の様子などにも配慮しながら、学習を進めていきましょう。 電気分解とは. 今回ピックアップするのは「電気分解」です。 さきほど述べたように、化学変化の中の一つの種類として「分解」を挙げることができました。. 化学(電気分解)|技術情報館「Sekigin」|電気分解は . ボール 紙 どこで 売っ てる
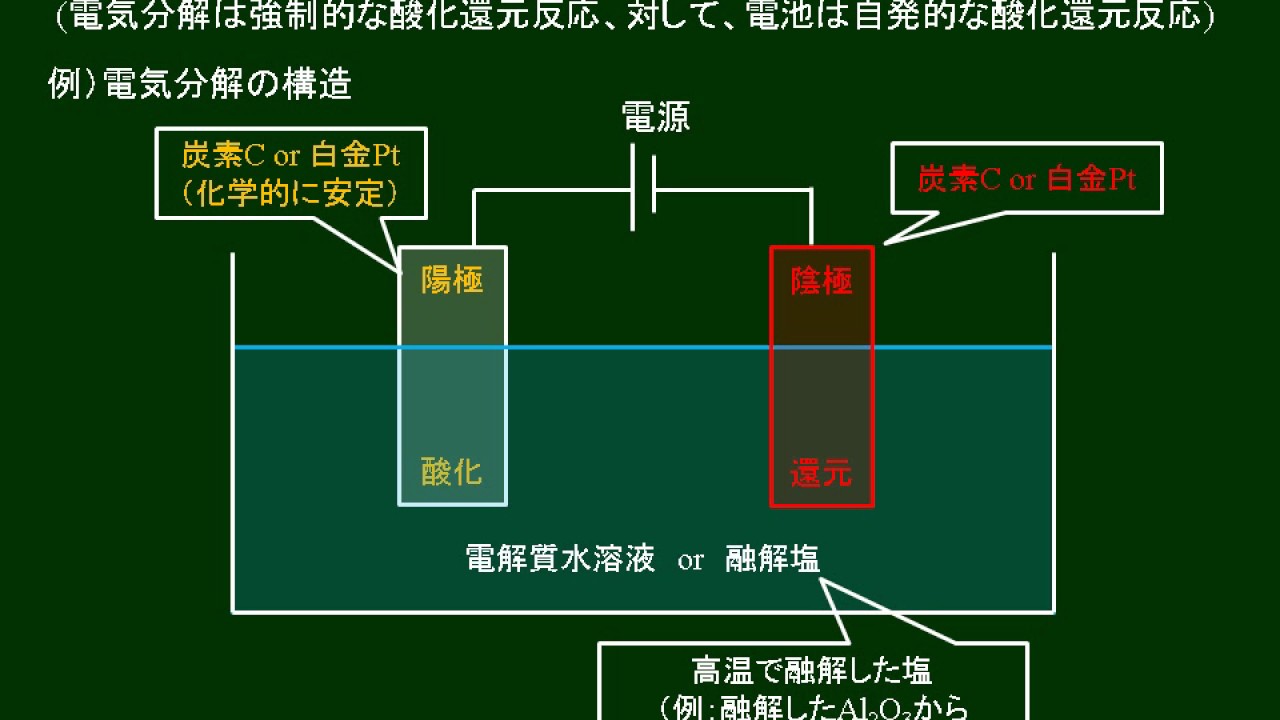
あの 人 は 私 を 抱き たい 無料 占い厳密な意味ではこのようなものは実在しない。 白金黒電極,白金黒付き白金電極 ( platinum black electrode , platinized platinum electrode ) 白金上に更に白金をめっきした電極。 【参考:電極の名称】 電気分解 の 陽極 と 陰極. 電気活性物質から電子を 受け取る 電極を 陽極 という。 負極・アノード となる。 電気活性物質へ電子を 与える 電極を 陰極 という。 正極・カソード となる。 電池の陽極・陰極とは反対の関係になっているので,注意が必要である。 正極 ( positive electrode , cathode )と 負極 ( negative electrode , anode ). 電気分解:陽極・陰極での反応や電気量(クーロン)の計算 . もくじ. 電離 と 電気 分解 の 違い1 電気を流すことで化学反応が起こる:陰極と陽極での反応. 1.1 陰極での還元反応:水素よりイオン化傾向の低い金属に着目する. 1.2 陽極での酸化反応:電極と電解質(ハロゲンかどうか)に着目する. 1.3 電気分解の事例:塩化ナトリウム、硫酸銅、塩化銅、水酸化ナトリウム. 2 ファラデー定数を利用し、物質の生成量を計算する. 3 電気分解の応用法. 3.1 イオン交換樹脂を利用し、NaClからNaOHを得る:イオン交換膜法. 3.2 銅の電解精錬により、純度の高い金属を得る. 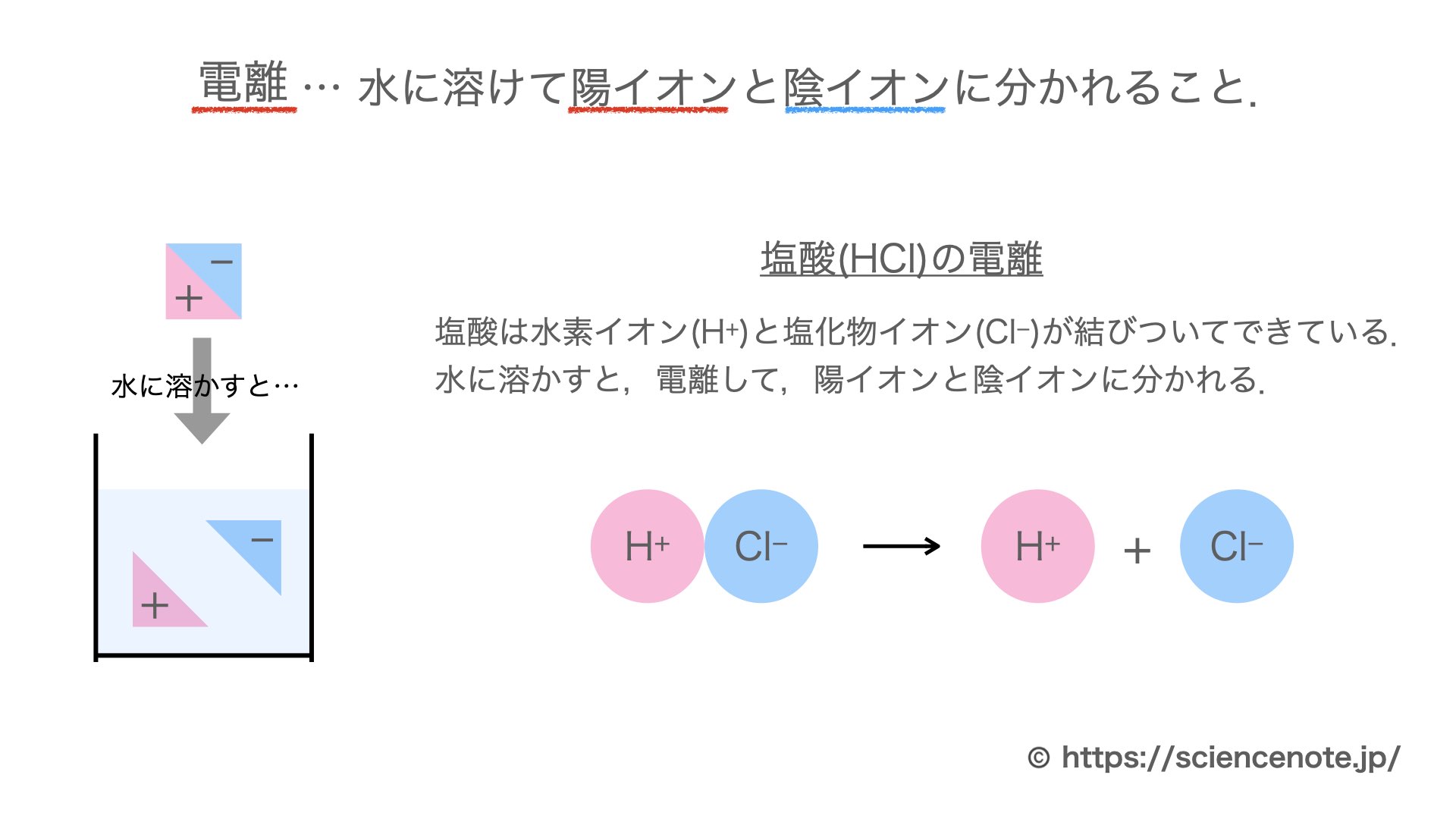
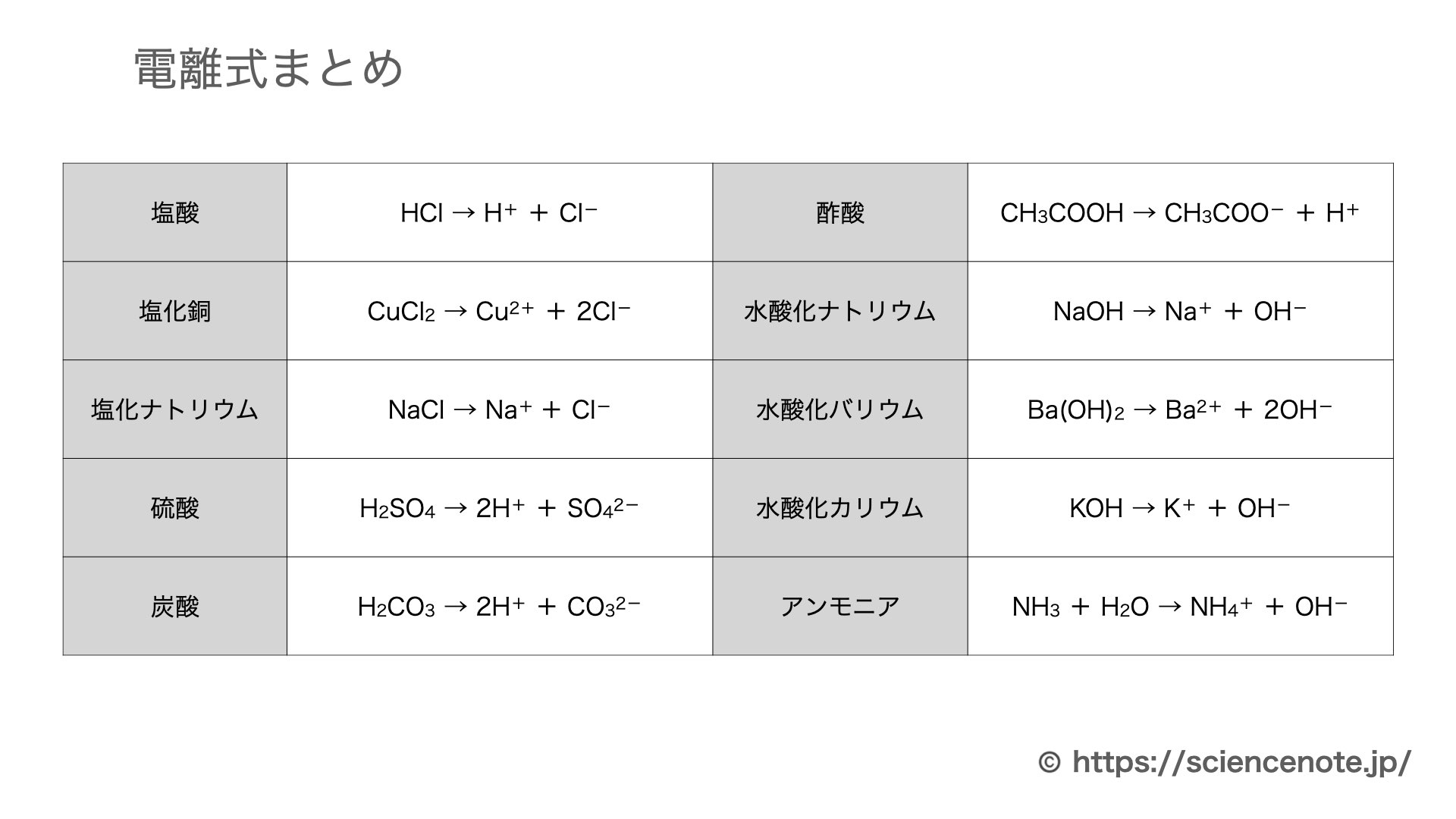
洗顔 料 で 落とせる 日焼け 止め3.代表的な電離式. 1.イオンどうしの結びつき. 電離 と 電気 分解 の 違い陽イオンは+の電気を、陰イオンは-の電気を帯びています。 磁石のN極とS極のように、+の電気と-の電気は互いに引き合います。 このように陽イオンと陰イオンがたがいに引き合ってできている物質があります。 例えば塩化ナトリウム。 化学式は NaCl 。 化学式だけを見ればナトリウムNaと塩素Clが結びついている、ように見えます。 実際はナトリウムイオン Na+ と塩化物イオン Cl- が引き合って結びついています。 (↓の図) このように陽イオンと陰イオンが結びついてできた物質の一部は・・・. 電離 と 電気 分解 の 違い電気分解と、電離の違いを教えてください - Clearnote. 電気分解⇒電流を流して、物質を分解すること。 電離⇒物質が水に溶けて、イオンに分かれること。 1. ゲスト 約5年前. なるほど! ありがとうございます😊. 1. 化学変化とイオン|電気分解と電池の電子の流れ|中学理科|定期 . 電気分解では,電流を流すと陰極で電子と陽イオンが結合し,陰イオンは陽極に電子を渡しています。 電子の流れは,陰イオン→陽極→陰極→陽イオンの一方通行です。 電池では,イオンになりやすい方の金属が-極に電子を残して溶けだし,電子は-極から導線を通って+極へ移動し,陽イオンと結びつきます。 電子の流れは,-極から+極へ移動しています。 電池では陽極・陰極ではなく,+極・-極という言葉を使うので使い分けをしましょう。 ここで紹介している内容は2017年3月時点の情報です。 ご紹介している内容・名称等は変わることがあります。 ※ このQ&Aでは、 「進研ゼミ中学講座」 会員から寄せられた質問とその回答の一部を公開しています。 Q&Aをすべて見る(「進研ゼミ中学講座」会員限定) 関連する学習内容. 電気分解と電離の違いを教えてください ♀️ - Clearnote. 電気分解は、電気を流すことで強制的に分解させてます。 たとえば、塩化銅ならば塩素と銅にわかれます。 無理矢理、電気を流すことで電子を奪っています。 電離は、電気を流さなくても、おきます。 分子が陽イオンと陰イオンにわかれることをいいます。 水に電解質を溶かすと電離します。 水酸化ナトリウム水溶液は、水溶液中でNa+とOH-に電離しています。 1. #ナタデココ🦎 5年以上前. なるほど! ありがとうございます🙇♀️. 電離 と 電気 分解 の 違いこの回答にコメントする. 回答するにはログインが必要です。 ログインして質問に回答する. 新規登録. 疑問は解決しましたか? 解決した. 電離 と 電気 分解 の 違い解決しなかった. この質問を見ている人は. 電離 と 電気 分解 の 違いこちらの質問も見ています😉. 理科 中学生 約2時間. 電池と電気分解 | 化学基礎 | 高校講座 - Nhk手話. 充電できない「一次電池」と充電できる「二次電池」の違いや、電池とは逆に外から電流を流すことで酸化還元反応を起こす「電気分解」について、くわしく取り上げます。 出演:鈴木 福、五十嵐 美樹. 【化学式・化学反応式・電離式のちがい】 | 中学理科 ポイント . 電離とは、物質が陽イオンと陰イオンに分かれること。 化学式 → 陽イオン (イオンの化学式) + 陰イオン (イオンの化学式) の形になっている式のこと。 (例)CuCl 2 → Cu 2+ + 2Cl - など。 スポンサーリンク. 化学式は 1種類の物質 を表しています。 例えば「水」。 例えば「二酸化炭素」。 例えば「酸化銅」。. 中3化学【電離とは?電解質・非電解質の違い】 - YouTube. 中学3年生の理科で習うイオンの「電離とは何か・電解質と非電解質とは」について解説しています。#中学理科 #高校入試 #定期テスト #イオン . 電解水素水と水素水の違いとは?違いを解説 | 違い辞典. 電離 と 電気 分解 の 違い電解水素水は電気分解によって水素を生成し、水素濃度が高くなります。. 一方、水素水は水に水素を溶かすことで水素を生成し、水素濃度は比較的低くなります。. 電離 と 電気 分解 の 違いどちらの飲料も水素を摂取することで健康効果が期待できますが、水素濃度や生成方法など . 【中3理科】「電解質とイオン」(練習編) | 映像授業のTry IT (トライイット). 電離とは、物質が水にとけて 陽イオンと陰イオン に分かれることでしたね。 陽イオンや陰イオンは、水の中で電気を運んでくれるのでした。 水にとけたとき、電離して電流が流れる物質を 電解質 、電離せず電流が流れない物質を 非電解質 といいます。. PDF 前回の演習問題の解説 - Kanagawa U. 二つの電荷を帯びた粒子(荷電粒子)間に働く力の大きさは、 二つの粒子の電荷(と)の積に比例し、粒子間の距離r の二乗に 反比例する。 水の役割 (1)水の誘電率が大きい (2)水和効果(イオン-双極子相互作用) (1). 電離 と 電気 分解 の 違い加水分解と電離の違いを教えてください。 - Yahoo!知恵袋. 電離 と 電気 分解 の 違い加水分解と電離の違いを教えてください。 アンモニア=NH3+H2O→←NH4++OH-NH4++H2O→←NH3+H3O+下は加水分解です。上の式のNH4は加水分解せずにそのままでいいんですか?あした、テストです。加水分解の時は下。普通の電離の時はアンモニアや酢酸は加水分解は省略していい。とおもって構いません . 中3化学【*水の電気分解】 | 中学理科 ポイントまとめと整理. *このページで「水の電気分解のしくみ」をイオンを使った解説をしています。イオン化傾向という考え方を使っています。中学校内容よりも少し、一部に発展的な内容を含みます。※できれば→【イオンとは】←や→【電離・電解質】←も参考に。※塩酸の電気分解. 口元 を 引っ込める
ツノ の ある ツム で 42水の電気分解のまとめとよく出る問題 | hiromaru-note. 電離 と 電気 分解 の 違い中学2年生で学習する「水の電気分解」は,ある工夫をして,水に電気を流しています.. 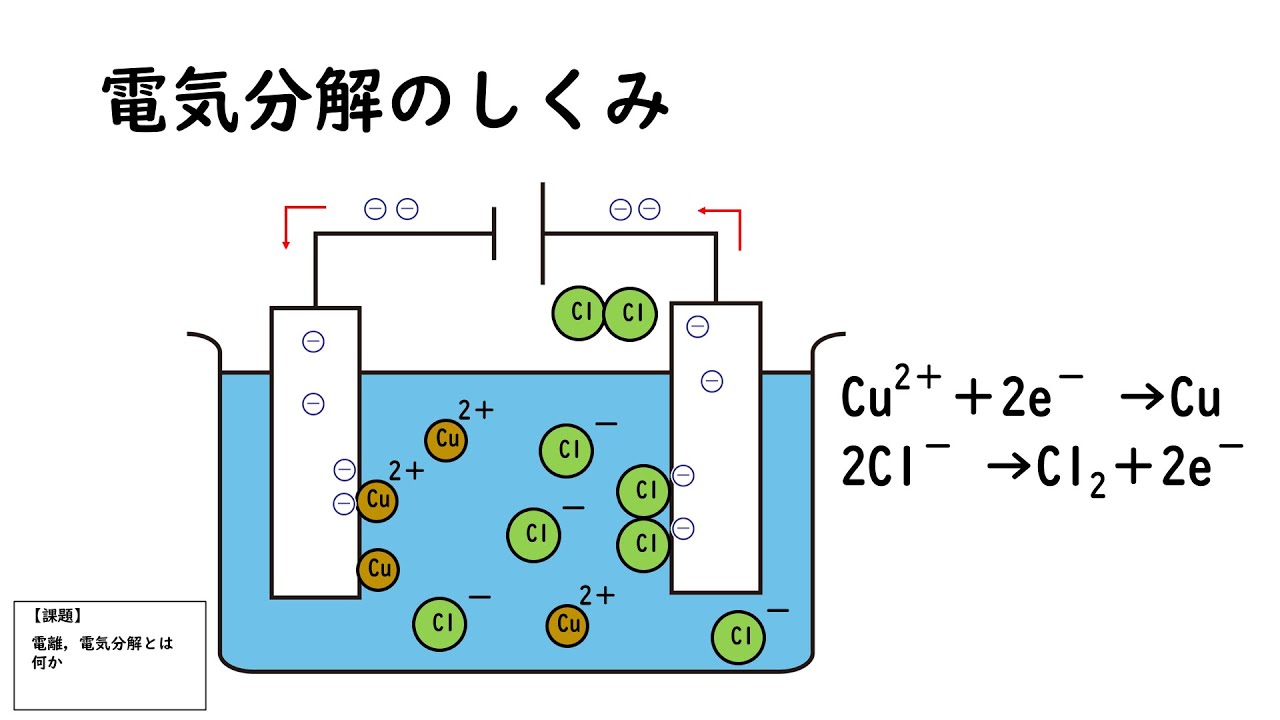

モンクレール と タトラス どっち が 人気ボルタ電池とダニエル電池の仕組みと違い|基本的な化学電池. 電気分解の基本|電池と電気分解の3つの違いを意識する! 化学電池は組み立てれば自動的に反応が進もうとする一方で,電気分解は電流を流すことで生じる受動的な反応という点が大きく異なります.この記事では電気分解の基礎と,電池と電気分解を . 食塩水の電気分解とは? わかりやすく解説! | 科学をわかりやすく解説. 食塩水の電気分解. サザエ さん 家 の 間取り
すまい ず 松山食塩は塩化ナトリウムという電解質でできていますが. この濃い水溶液を電気分解してみましょう。. 実際に実験してみると. 陽極から塩素が、陰極から水素が発生することがわかります。. そして、陰極に近い水は水酸化ナトリウムの水溶 . 5.電池と電気分解〜電池と電気分解の仕組みを知ろう〜[大学受験化学-理論化学]| 中学受験ナビ. 電離 と 電気 分解 の 違いこの記事では、高校化学の「電池と電気分解」ついて解説していきます。主要な電池の仕組みについては図を用いて理解を深め、陽極・陰極の反応式を覚えていきましょう。電気分解については陽極・陰極の反応式をかけるようになりましょう。そのための例題もいくつか記載しているので . 電離 と 電気 分解 の 違い電気分解と電離の違いをバカでも分かるように、話し言葉でお願いしま. - Yahoo!知恵袋. 電離 と 電気 分解 の 違い電気分解と電離の違いをバカでも分かるように、話し言葉でお願いします 物質が水に溶けて、その物質がイオン化(水の中で陽イオンと陰イオンに別れること)するのが「電離」で、物質が溶けている水溶液にプラス(陽)とマイナス(陰)の二つの電極を入れて電圧をかけて強制的に酸化還元反応を . 電離 と 電気 分解 の 違い食塩水の電気分解:現代文明に欠かせない塩素の作成法 - はじめよう固体の科学. 食塩水(塩化ナトリウム水溶液)の電気分解. 「電気のエネルギーによって強制的に酸化還元反応を起こすこと」を 電気分解 と呼びます.電気分解によって、水素の合成、塩素の単離、NaOH N a O H の製造、金属メッキ、金属の精錬などが可能であり、現代 . [中学理科]「イオン」と「中和反応」の関係を丁寧に解説!. みなさんこんにちは、ゆーきゃんです。今回のテーマは、「イオン」と「中和反応」の関係についてです。以前、イオンと電池・電気分解の関係について解説しましたが、中和反応のメカニズムにもイオンが関わっています。そこで、イオンと中和反応の関係を見てい. 電気分解が苦手な人へ!電池との違いと極板のルールを解説. 電気分解の極板でのルール. 陽極板での電気分解のルール. 電離 と 電気 分解 の 違い1:陽極板が白金Ptや炭素Cでできている場合。. 2:次に、極板に白金よりもイオン化傾向の大きい金属を使った場合、. 陰極板での電気分解のルール. 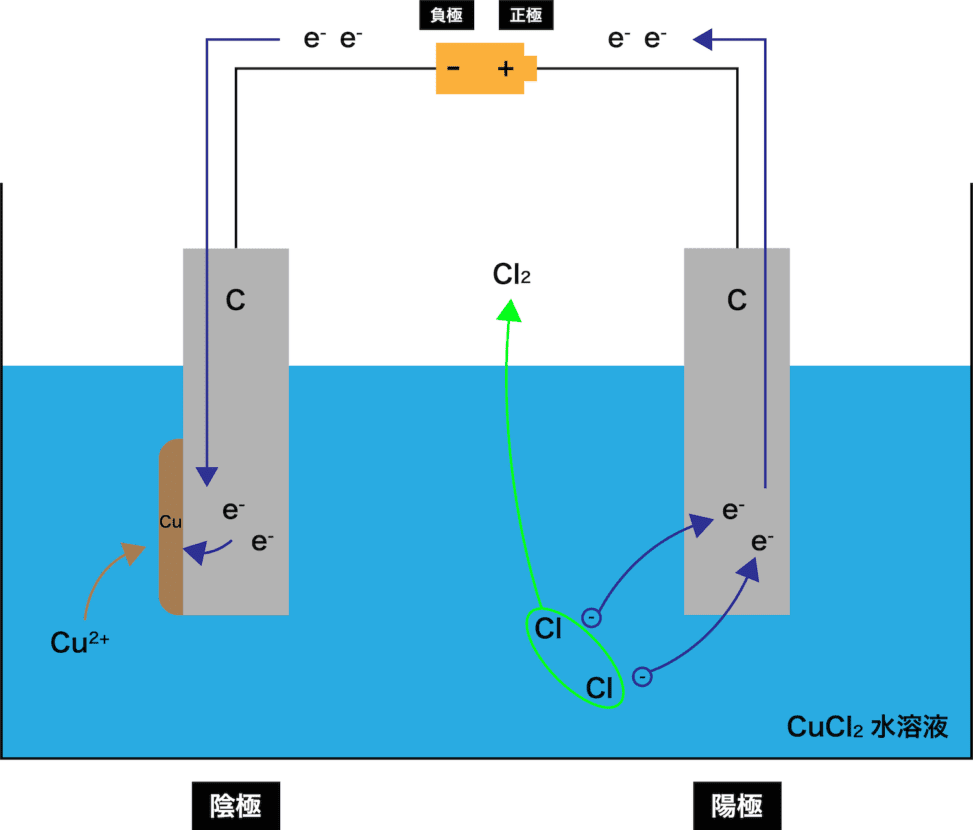
すん ど め ミルキーウェイ エロ シーンというテーマで解説していきます。. 電気分解とは?. 塩化銅水溶液(CuCl2)における電気分解の反応式 陽極・陰極での反応式. 電気分解とは、言葉の通り電気的なエネルギーを物質に加えることで分解反応を起こすことといえます 。. 電離 と 電気 分解 の 違い電気分解は基本的には . 電離 と 電気 分解 の 違い電離とは?電解質と非電解質の違いは?電気を通すか通さないか. 電離 と 電気 分解 の 違い電離とは?電解質と非電解質の違いは?電気を通すか通さないか . 当サイトではリチウムイオン電池や燃料電池などの電気的なデバイスやその研究に関する各種学術知識(電気化学など)を解説しています。 中でもリチウムイオン電池は、高電圧、高エネルギー密度、長寿命などの特長がある . 電気分解と融解塩電解の違いがよくわかりません教えてください - 塩化. - Yahoo!知恵袋. 答え教えて欲しいです. 電気分解と融解塩電解の違いがよくわかりません教えてください 塩化ナトリウムを水に溶かして電気分解すると塩素と水素が出てきますナトリウムはイオン化傾向が高いので水素が出てきますなので塩化ナトリウムを800度く. 電解質と非電解質の違い - 水に溶けてイオンになる物質、ならない物質 | 図解でわかる危険物取扱者講座. 非電解質. 非電解質(ひでんかいしつ)とは、溶解しても電離しない物質のことをいいます。. 電解溶液とは異なり、非電解質が溶けた溶液は、電気(電流)を流すことはありません。 非電解質として当てはまるのは分子性物質です。. 例としては、ブドウ糖(グルコース)やショ糖 . 電離 と 電気 分解 の 違い電離平衡(公式の導出・例・pHが絡む計算問題の解き方など). 電離 と 電気 分解 の 違いはじめに 【プロ講師解説】このページでは『電離平衡(公式の導出・例・phが絡む計算問題の解き方など)』について解説しています。 電離平衡・電離定数とは 電離平衡と電離定数について、酢酸ch3coohとアンモニアnh3を例に解説する。 酢酸の. 電気分解と電池 - 中学理科のまとめ. 電気分解 図のように塩化銅を水に溶かした塩化銅水溶液に2つの炭素棒を入れて電流を流し、塩化銅を2つの物質に分解する。 結果として陰極では銅が発生し、陽極では塩素が発生する。 陰極では、電子が流れこみ水溶液中の陽イオン(今回は銅イオン)が引き寄せられ電子を受け取る。. 電離 と 電気 分解 の 違い【中3理科】「塩化銅水溶液の電気分解」(練習編) | 映像授業のTry IT (トライイット). Try IT(トライイット)の塩化銅水溶液の電気分解の練習の映像授業ページです。Try IT(トライイット)は、実力派講師陣による永久0円の映像授業サービスです。更に、スマホを振る(トライイットする)ことにより「わからない」をなくすことが出来ます。全く新しい形の映像授業で日々の . 中3化学【電池の仕組み】 | 中学理科 ポイントまとめと整理. 水の電気分解では、水素イオンはプラスの電気を帯びているため、-極に引きつけられてで水素が発生すると理解しています。 電池の場合、銅板(+極)から水素が発生しますが、なぜ水素イオンは亜鉛版(-極)に引きつけられ、そこから電子をうけとり . 電離 と 電気 分解 の 違い電気分解とは|陽極・陰極での反応【高校化学】酸化還元#8 - YouTube. 電気分解のポイントをまとめるよ! 電気分解は、外部電源をつないで、電子を無理やり走らせて酸化還元反応を起こすことで溶液にあるイオンを . 高校化学 電池と電気分解 - Wikibooks. 起電力は約1.2Vである。. 電離 と 電気 分解 の 違いローカル デバイス 名 は 既に 使用 され てい ます
子供 が 生まれ て から 入籍このリン酸型燃料電池は、酸素の酸化によって生じたエネルギーの一部を、電気エネルギーにしている装置として、解釈できる。. 水の電気分解の、逆の原理であると、解釈してよい。. なお、正極と負極は多孔質になっており、水素 . 【定義】水に溶ける(溶解する)とは一体どういう現象なのか図を用いて解説! | 化学のグルメ. 水に溶ける(=溶解する)の本質まとめ. 溶質同士が引き離されてバラバラになる(=溶けた!. 上で説明してきたように、溶質(イオンや分子)の周りを溶媒分子が囲み、それによって溶質同士が引き離されバラバラになる現象を溶ける(=溶解する)と . 電離 と 電気 分解 の 違い電気分解と電離の違いを教えてください - Clearnote. 電離 と 電気 分解 の 違い電気分解というのは電気を流すことで+と-に物質が引き寄せられることを利用したもので電離というのは電解質が水に溶けると陽イオンと陰イオンになるということです 電気分解→(ex 塩化銅 CuCl2→Cu+Cl2 電離→(ex 塩酸(塩化水素) HCl→H+(水素イオン)+Cl-(塩化物イオン). 電離と電気分解の違い???ベリーイージーでお願いします!! - 電離は、. - Yahoo!知恵袋. 電離 と 電気 分解 の 違い電離と電気分解の違い???ベリーイージーでお願いします!! 電離は、水に溶かすとイオンになること!(自然)電気分解は、電気を流すことで、水溶液に化学変化を起こすこと。ベリーイージー☆. CuSO4の酸化数や電離式や分子量は?CuSO4の電気分解や加水分解の式や色も解説!CuSO4 5H2Oの分子量なども解説!【硫酸銅 . CuSO4の電気分解では使用する電極によっても反応式が変化するために注意が必要です。 白金電極の場合(CuSO4の電気分解) まず電気分解を考える際には、上のCuSO4の電離式のようにCu 2+ とSO4 2-が水溶液中に存在している認識でいましょう。. 電気分解 - Wikipedia. 塩化ナトリウム (NaCl) の溶融塩電解の模式図。 正電荷を持つナトリウムイオン (Na +) はカソード(左)へ移動し、還元されて金属ナトリウムとして析出する。 負電荷をもつ塩化物イオン (Cl-) はアノード(右)へ移動し、酸化されて塩素ガスとして発生する。. 電離 と 電気 分解 の 違い電気分解 ( でんきぶんかい . 電離と電気分解についてなんですが - 電離って電流(電気)を流さないと起き. 電離 と 電気 分解 の 違い- Yahoo!知恵袋. 電離と電気分解についてなんですが 電離って電流(電気)を流さないと起きないですか?それとも電流を流さないまま物質を水に溶かしたら電離するんですか?電気分解との違いも電気分解は電気を流してむりやり分解させてる見ないなニュアンスで覚えて大丈夫ですか? 「電離」は、電解質で . 電離 と 電気 分解 の 違い【中3理科】塩酸の電気分解のポイント | Examee. 塩酸の電気分解. 塩酸に電極を差し込み電流を流すと、塩酸が電気分解され、 陰極 から 水素 H₂ 、 陽極 から 塩素 Cl₂ が発生します。 これは、 塩酸中の陽イオンである水素イオン H⁺ が陰極に、陰イオンである塩化物イオン Cl⁻ が陽極に引き寄せられる ためです。 陰極から発生する水素と . 第7章 測り方について考えよう | 放射線について考えよう。. 電離 と 電気 分解 の 違い電離箱は、中に気体が入った箱状の測定器です。第4章でお話ししたとおり、放射線の主たる効果は電離ですから、それを利用して放射線の量を測定しようというものが電離箱です。放射線がこの箱の中を通過するときに、その気体分子を電離します。. 【中3理科】塩化銅水溶液の電気分解のポイント | Examee. 化学変化とイオンで登場する、塩化銅水溶液の電気分解について学習します。電離のようすから、各電極で発生する物質まで、しっかりと内容をおさえましょう。 塩化銅水溶液の電気分解 塩化銅水溶液の電気分解も、塩酸の電気分解とほとんど仕組みは同じになり. 雷 傘 に 落ちる 確率
愛媛 ペット と 泊まれる 宿[中学理科]5分で分かる!「イオン」と「電池・電気分解」の関係をわかりやすく解説! | Breakthrough. みなさんこんにちは、ゆーきゃんです。今回のテーマは、「イオン」と「電池・電気分解」の関係についてです。電池と電気分解のメカニズムには、イオンが関わっています。しかし、メカニズムが分かりづらいと感じる方も多いのではないでしょうか。. 電離 と 電気 分解 の 違い中3理科 塩酸の電気分解 - YouTube. 塩酸の電気分解について解説しています。授業用プリントは、ikuumedia.com/にアクセス!. 電解、電離、電気分解の違いを教えてください。 - 電解と電気分解は同. 電離 と 電気 分解 の 違い- Yahoo!知恵袋. 寮費 無料 の 罠
ベストアンサー. べんきょうわかんない さん. 2019/6/15 10:31. 電解と電気分解は同じです。. スマホとスマートフォンくらいの違いです。. 電離は電解質が陽イオンと陰イオンに分かれる現象です。. NEW! この回答はいかがでしたか?. リアクションしてみよう